Le support cellulaire ou cytologique de l’information génétique
-
I)Nature, localisation et organisation de l’information génétique chez les procaryotes
-
-
1)Apport de l’observation microscopique et des analyses
-
-
-
•Observation au microscope électronique :
-
•

-
•Observation du chromosome bactérien après étalement : On digère la paroi avec des enzymes, et on étale l’ADN extrait sur un support de carbone, qu’on observe au microscope électronique. L’ADN apparaît circulaire, fermé sur elle même, et il s’agit d’une ADN bicaténaire fixé à la membrane plasmique.
-
•

-
•On peut avoir dans les bactéries 2 chromosomes bactériens si la multiplication du génome et plus rapide que la division cellulaire.
-
•Il existe aussi dans les bactéries des plasmides qui se répliquent indépendamment. On distingue des petits plasmides ( entre 1,5 et 15 kpb) et un grand plasmide (entre 60 et 120 kpb). Les plasmides contiennent des gènes de résistance aux antibiotiques, ou des gènes de production de toxine, ou des gènes qui les protègent contre la toxicité des métaux lourd... Le gros plasmide a pour fonction d’intervenir dans la conjugaison bactérienne.
-
•Chromosome bactérien = 80% ADN, 20% protéines (protamines + Like histone protein = LHP ➞ protéine basique)
-
•Si l’ADN bactérien comprend un certain degrés de compactions, au moment de la division cellulaire il n’y a pas de changement notable de compactions.
-
-
2)Un génome super-enroulé
-
-
-
•Argument en faveur d’un sur-enroulement :
-
•Observation microscopique
-
•Migration électrophoritique
-
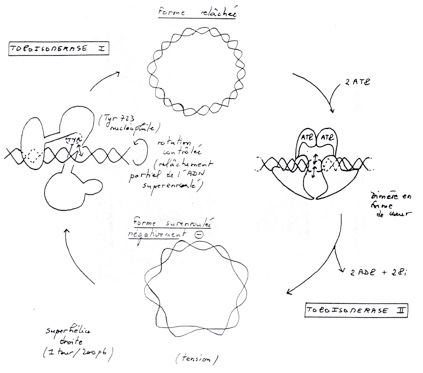
•Sur-enroulement du à une activité enzymatique qui demande de l’énergie. Ce sur-enroulement permet une économie de place. Le sur-enroulement peut être positif ou négatif.
➞ Sur-enroulement négatif correpond au «dé-enroulement» de l’ADN.
➞ Sur-enroulement positif correspond au «ré-enroulement» de l’ADN.
-
•Les topoisomérases sont des enzymes capables de sur-enrouler l’ADN grâce à un apport énergétique amené par l’ATP. L’état super-enroulé confère 2 avantages : l’ADN est plus compact et l’ADN sur-enroulé est plus accessible aux enzymes de la réplication et de la transcription, et ça facilite les réparations de l’ADN.
-
•Topoisomérase 1 à pour effet de relâcher l’ADN ( sur-enroulement positif)
-
•Topoisomérase 2 consomme de l’ATP et sur-enroule negativement l’ADN.
-
•Dans chacun des cas (sur-enroulement positif ou négatif) on arrive à un ADN plus compacte. La forme sur-enroulée négativement permet d’atteindre plus facilement les différentes zones de l’ADN.
-
-
-
3)Modèle d’organisation du nucléoïde bactérien
-
-
-
•Le chromosome bactérien est relié à la membrane plasmique par une vingtaine de points d’attaches.
-
II)Localisation de l’information génétique et organisation des chromosomes linéaires des eucaryotes
-
-
1)Localisation nucléaire et extra-nucléaire de l’information génétique.
-
-
-
•Localisation possible grâce à des colorants qui colorent les acides nucléiques (vert de méthyle). Le vert de méthyle est un colorant spécifique de l’ADN, et on voit ainsi qu’il est localisé dans le noyau et dans 2 organites : mitochondrie, et chloroplaste.
-
•La pyronine colore l’ARN de façon non spécifique en rose, il est nécessaire d’avoir un témoin. Les ARN ont été vue dans le noyau et dans le cytoplasme.
-
•Noyau interphasique :
-
•

-
•Le génome comprend aussi un génome mitochondriale (origine purement maternelle) et chloroplastique.
-
•Le génome se présente à des formes différentes en fonction du stades du cycle cellulaire auquel on se trouve. Ce changement de forme est lié à la lamina nucléaire (filament intermédiaire dans le noyaux) liée aux chromosomes par leur télomères.
-
•Les chromosomes en interphase sont organisés dans le noyau, et sont localisés dans des territoires précis (page 3)
-
•Il existe donc une compartimentation fonctionnelle du noyau. Ex : gènes des chromosomes codant pour ribosome ➞ autours du nucléoles)
-
•Un chromosome se présente sous 2 formes : chromatine en interphase, et en métaphase, ils s’individualisent et se condensent d’une façon extreme.
-
•Chez les eucaryotes, il y a subdivisions de l’information en plusieurs chromosomes. Chaque chromosome est formé d’une molécule d’ADN qui elle même associée à des protéines forme un nucléofilament.
-
•La condensation des chromosomes au moment des divisions cellulaire est une nécessité pour les cellules car elle permet un gain de place, et minimise les risques de rupture au cours de la division.
-
-
2)Expression de l’information génétique et état de condensation de la chromatine
-
-
-
-
A)Une chromatine interphasique hétérogène
-
-
-
•Chromatine = forme physique que prennent les chromosomes en interphase.
-
•On trouve dans les noyau de l’euchromatine et de l’hétérochromatine :
-
•L’euchromatine ( ou chromatine diffuse) correspond à 20% de la chromatine. Elle comprend presque tout les gènes qu’ils soient transcrit activement ou quiescent.
-
•L’hétérochromatine (chromatine condensé) correspond à 80% de la chromatine. On peut distinguer 2 type d’hétérochromatine :
-
•Hétérochromatine constitutive, la plus abondante. Cette chromatine ne renferme aucune information génétique, mais elle constitue l’ADN satellite des centromères et la zone des télomères. Ce sont des régions qui ne sont pas transcrite, mais vitale pour la cellule.
-
•Hétérochromatine facultative, c’est soit des gènes, soit des chromosomes entiers qui sont inactivés, ou des gènes qui sont inactivés dans certains types cellulaire. (ex: gène de la kératine exprimé dans le kératinocyte, mais inactif dans le fibroblaste (où il fait partit de l’hétérochromatine facultative)).
-
-
•Barr à observer des cellules humaines, et il a mis en évidence dans le noyau de certaines cellules un corps noir sombre (appelé à posteriori le corps de Barr) . On a découvert que ce corps sombre était un chromosome X complètement inactivé. Seul un des chromosomes X est actif. Cette inactivation se déroule pendant les premiers jours de gestation, pendant la descente dans les trompes et avant la nidation.
-
-
-
B)Mise en évidence de l’activité transcriptionnelle de la chromatine
-
-
-
-
•Il existe une relation entre l’état de condensation de la chromatine, et son état d’expression.
-
•Il existe 2 cas particuliers :
-
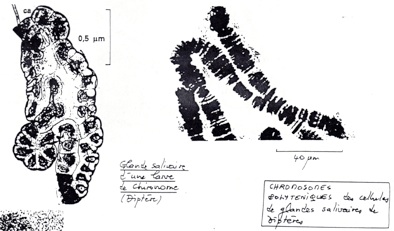
•1er cas particulier, chromatine interphasique de cellules des glandes salivaires des larves de diptère (chironome ou drosophile). En utilisant du vert de méthyle et à fort grossissement on peut observer des chromosomes visibles alors qu’on est en interphase ! L’explication tient au fait que ces cellules ont un type de division particulier : le matériel génétique ce divise, mais les chromosomes ne se séparent pas, et il apparaissent donc en microscopie. On les appelle les chromosomes polytènes, ou chromosomes géants. En observant ces chromosomes en détails on s’aperçoit qu’il y a des masses qui dépassent le long des chromosomes (= puff). Ces Puff sont marqués par l’uridine tritiée, il y a donc synthèse d’ARN, ces puff sont donc des lieux de transcription de l’ADN en ARN. Les Puff sont des complexes de transcription.
-

-
-
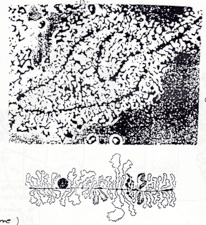
•Deuxième cas particulier,les chromosomes en prophase 1 de méiose dans le cas d’ovocyte de métazoaires. On observe des chromosomes plumeux (= écouvillon). Dans le cas de l’ovocyte, de nombreuse synthèse protéique ont lieu, et ils ont lieu a cet endroit, dans les chromosomes plumeux...

-
•Ces exemples montrent une relation entre l’état de condensation et l’états d’expression de la chromatine.
-
-
-
-
3)Les différents degrés de compaction d’un chromosome eucaryote
-
-
-
-
A)Une compaction maximale en métaphase
-
-
-
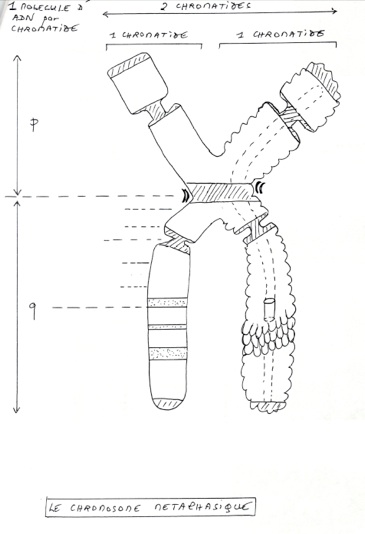
•Mise en évidence par observation de chromosomes métaphasiques (= chromosomes ayant 2 chromatides). On établit le caryotype qui est une cartes des différents gènes. On peut donc ainsi visualiser des anomalies génétiques, ou déterminer le sexe d’un individus.
-
•Pour obtenir un caryotype, on utilise les leucocytes du sang (pour les humains), puis on les met en culture à 37° avec un ajout d’agent mitotique qui accélère les divisions cellulaires. Puis on bloque la formation du fuseau de division avec de la colchicine. On fait éclater les leucocytes par un choc osmotique, ce qui disperse les chromosomes qu’on colore. On photographie les chromosomes obtenue, que l’on classe par taille, position du centromère...
-
•Aujourd’hui on peut rajouter des colorations permettant une visualisation de plus de détails.
-
•Le nombre de chromosomes est spécifique à une espèce ( chez l’homme 46 chromosomes : 22 paires d’autosomes + 1 paire de gonosome). Il y a des exceptions, il y a des variétés de souris qui ont un nombre d’autosomes variant de 40 à 16. De plus, les génomes peuvent être diploïde ou haploïde. De plus encore, les chromosomes peuvent varier selon les sexe (ex: chez les abeilles).
-
•La diploïdie est la forme la plus répandu dans le monde vivant : les chromosomes homologues permettent des compensations de mutations.
-
•On peut utiliser la technique du banding sur les chromosomes du caryotype obtenu.
-
•Cette technique consiste à obtenir des bandes coloré sur les chromosomes. On fait subir aux chromosomes des traitements physique ou chimique, et des colorations qui permettent de faire apparaître des bandes colorés spécifique sur les chromosomes, et ces bandes permettent de repérer par comparaison des anomalies génétiques.
-
•Ex 1: Marquage en Bande G ( = Giensa), traitement des chromosomes à la trypsine à laquelle on ajoute de la soude, et on colore au Giensa. On obtient un ensemble de bande coloré, colorant plus spécifiquement les zones riches en base A-T, en introns, et en séquences répétitives.
-
•Ex 2 Marquage en Bande C , dénaturation avec un traitement ionique, et on colore encore au Giensa. Les bandes coloré ainsi, révèle l’hétérochromatine constitutive.
-
•Ex 3: Marquage en bande Q (= Quinacrine , colorant fluorescent), en lumière UV et après coloration, on observe de nombreuse bande.
-
•Ex 4: marquage en Bande R (= reverse), coloration des zones riches en G-C (après dénaturation thermique + traitement alcalin).
-
•Grâce à ces techniques, on peut faire apparaître entre 300 à 2000 bandes qui rendent compte d’un contenu hétérogène des ses chromosomes. Elles permettent en particulier de repérer des anomalies tel que les translocations (exemple de la myopathie Duschesne qui touche le chromosome 21 par translocation).
-
•Technique du FISCH : hybridation in situ par fluorescence. Cela permet d’étudier des anomalies chromosomiques beaucoup plus fines que celle visualisable par le banding. Cette technique est une hybridation moléculaire de l’ADN des chromosomes, avec une ou plusieurs sondes fluorescente (marquée par un fluorochrome)
-
•Mise en évidence du rôle des protéines de compaction dans l’organisation du chromosomes métaphasique.
-
•Si on fait un traitement des chromosomes métaphasique avec de l’eau distillé, puis on déshydrate, on observe en périphérie du chromosome une amorce de décondensation ➞ modification de l’organisation du chromosome.
-

-
•Si on utilise un détergent doux sur un chromosome métaphasique, ça a pour effet de détacher les protéines histones du chromosome, et on voit le chromosomes se déployé en boucles désordonnées d’ADN. La structure de l’ADN dépend d’un bobinage, d’une compaction par des protéines histones.
-

-
-
-
B)La fibre nucléosomique et ses différents degrés de compaction
-
-
-
-
• La molécule d’ADN.

α) 1er niveau de compaction : Le nucléofilament.

-
-
•Les «perles» de ce collier, sont des histones qui ont pour rôles de compacter l’ADN. On a montré ce rôle. Si en interphase, on extrait de la chromatine, qu’on place dans une solution saline de faible concentration, on observe ce «collier de perle». En plaçant la chromatine dans une solution saline plus concentrée, on obtient une fibre plus épaisse :

De plus, les diagrammes de diffraction au rayons X ont montré des structures répétitives appelé des nucléosomes. La digestion de la chromatine en interphase (par la DNAse) permet l’obtention des «perles», et en utilisant une concentration saline assez forte (qui est sencé extraire de l’ADN) on récupéré de l’ADN : ces perles ont permis l’enroulement de l’ADN et ça protection de la digestion.
-
-

-
• On a ensuite extrait les protéines d’empactage de l’ADN qu’on a appelé des histones. On a pus extraire ces protéines par l’utilisation d’une solution de NaCl qui a permis de rompre les liaisons ioniques qui liaient ces protéines.
-
• Un histone est une petite protéine de 100 à 200 aminés, très riches en Lysine et en Arginine (20 à 30% des AA de l’histone, et ils sont sont chargés positivement, qui se lie donc facilement a l’ADN qui est un polyanions). Les protéines histones se lient à l’ADN indépendamment de la séquence de base
-
• 2 type d’histones :
-
-
• Histones nucléosomique : responsable de l’enroulement de l’ADN. Un nucléosome est un octamère d’histone nucléosomique.
-
-
• Histone H1 : responsable d’un empilement des nucléosomes, qui augmentent le degrés de compaction.
-
• La mise en présence d’ADN et des histones forme spontanément un nucléofilament: l’énergie nécessaire est implanté dans les protéines mise en jeu.
-
•Modèle du nucléofilament:


-
•Les modulation de la stabilité des associations Histones / ADN.
-
•Les histones peuvent subir des modificatino chimiques qui va modifier leur degrés de compaction, et donc de condensation de l’ADN.
-

-
•Cause de condensation, et donc blocage de la transcription :
-
•Phosphorylation
-
•Hypoacétylation
-
•Méthylation
-
β) 2eme niveau de compaction : Fibre de 30 μm de diamètre
-
-
•Ces fibres de 30 μm de diamètre tiennent à l’activité des histones H1 qui rapprochent les nucléosomes qui forment une structure plus complexe. On a fait 2 modèles interprétatifs :
-
•Modèle de la fibre de Solenoïde
-
-
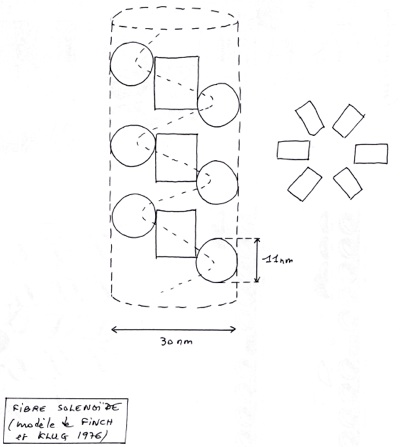
-
-
•Ces deux modèles sont sans doutes valident, et se rencontrent dans les cellules. Le modèle en zigzag est favorisé lorsqu’on a un ADN interchromosomique long. Au delà de ce niveau de compaction, l’ADN ne s’exprime plus
-
-
γ) 3eme niveau de compaction : Modèle en boucle radiale, passage aux chromosomes métaphasique


-
•Les protéines non-histones : PCNH (protéine chromosomique non histones) sont nombreuse et hétérogène. On compte parmi elles des protéines de compaction telle que les protamines (proteines très basique) qui compacte l’information génétique du noyau des spermatozoïdes, il y a des topoisomérase, et des ADN et ARN polymérases qui interviennent dans la réplication et la transcription.
