Condition de réalisation des réactions chimiques dans la cellules, propriétés et caractère des enzymes
Introduction : Les enzymes sont des acteurs des réactions métaboliques de l’organisme ( anabolisme [réaction de synthèse] et catabolisme [réaction de dégradation]).
On peut noter la naissance des travaux sur les enzymes de Réaumur et de Spallanzani en 1780. Ils ont étudié la digestion in vitro in vivo. Des ces expériences ils avaient déduit que la digestion se traduisait par une simplification moléculaire. Ce processus pouvait se faire à l’intérieur ou à l'extérieur du corps. Il faut attendre 1833 pour que 2 chercheurs, Payen et Persoz, isolent une substance, l’amylase, capable d’hydrolyser l’amidon (issus de l’orge).
Le terme d’enzyme apparaît en 1878, par un chercheur appelé Kühne, pour désigner des ferments chimiques. En 1896, les frère Buchner comprennent et découvrent (après les travaux de pasteur) qu’on peut réaliser la fermentation alcoolique hors des cellules en utilisants des levure qu’ils font éclater, et dans les extraits recueillis, il existe une substance agissant comme un catalyseur chimique. Ainsi ils comprennent qu’il existe dans le corps des catalyseurs chimiques.
Aujourd’hui on sait que ces molécules ont des propriétés particulières car ce sont des composés protéiques. Leur caractère protéique les rends spécifiques, et leur fonctionnement contrôlé, qui permet un contrôle des réactions métaboliques. On estime entre 1000 à 4000 le nombre d’enzymes dans les cellules animales.
-
•POLY «QUELQUES NOTION DE THERMODYNAMIQUE»
-
I)La cellules, un système ouvert en état stationnaire de non équilibre
-
-
1)Mesure du travail chimique au cours d’une réaction non redox et ses de la réaction
-
-
-
•Réalisation de réaction grâce à un travail chimique:
-
-
•aA + bB ⇔ cC + dD
Δ°rG = (ΣG des produits - ΣG des réactifs) -
•On définit Δ°rG = variation d’enthalpie libre dans les conditions standarta:
-
•T = 296K (25°C) (souvent 37°C soit 310K)
-
•P = 1,013.105 Pa ( = 1 atm)
-
•1 mol.L-1 = 1 M (pour tout les corps dissous sauf H+)
Pour [H+] = 1M = pH = 0 -
•On définit : ΔrG°’ pour le pH 7 ou la concentration en [H+] = 10-7 mol/L-1
-
-
•Relation fondamentale : ΔrG = ΔrG°’ + RT . Ln ([C]c . [D]d / [A]a . [B]b)
Soit ΔrG = ΔrG°’ + RT. ln Keq
A l’équilibre : ΔrG = 0
Il vient ΔrG°’ = - RT . ( [C]c . [D]s / [A]a . [B]b ) = - RT . Ln Keq
ΔrG°’ ne dépend que de la constante d’équilibre Keq qui est une constante. -
•Selon les concentration des réactifs à l’équilibre on peut définir le sens de la réaction :
-
•Si Keq = 1 ; ΔrG°’ = 0
-
•Si Keq > 1 ; ΔrG°’ < 0 ➞ réaction exergonique
-
•Si Keq < 1 ; ΔrG°’ > 0 ➞ réaction endergonique
-
•La valeur de ΔrG°’ est une variable qui dépend de la concentration des réactifs au sein de la cellule à un moment considéré. ΔrG indique donc l’état d’avancement d’une réaction par rapport à l’équilibre.
-
•Pour le déroulement d’une réaction, ce ne sont pas les concentrations absolues des réacteurs / produits qui sont importante mais leur rapports de concentration.
-
-
2)Mesure du travail chimique au cours d’une réaction redox et sens de la réaction
-
-
-
•Travail de transfert d’électrons : énergie chimique d’oxydo-réduction ou E.
-
•On peut définir un potentiel redox standard:
-
•Potentiel redox standart : E°(volt)
-
•Concentration molaire
-
•25°C, 298K (mais souvent à 37°C, 310K)
-
•P= 1,013.105 Pa
-
•pH=0, si pH=7 ➞ E°’
-
•Dans ces conditions le potentiel redox d’un couple donné est fourni par la relation de Nernst :
-
•E= E°’ + (RT/nF) . Ln ([ox]/[red])
-
•Le transfert d’électrons d’un couple vers un autre constitue un travail chimique
-
•Une différence de potentiel redox correspond à une forme d’énergie potentielle dont on peut déterminer la valeur :
-
•ΔG = - nF . ΔE , Le - indique un passage spontané des électrons dans le sens des potentiels redox croissant.
-
•A+/A ➞ B+/B
E1 < E2
ΔE = (E2 - E1), ΔG < 0 (indique que E2 > E1) : Il y transfert spontané des électrons de A+/A à B+/B. -
-
II)Les propriétés générales des enzymes
-
-
1)Les enzymes abaissent les énergies d’activation des réactions catalysées
-
-
-
•Pour qu’une réaction chimique se produise, il est nécessaire qu’il y ait une certaine proportion de molécules qui possèdent à un moment donné, une énergie suffisante pour pouvoir réagir. Cette énergie va rendre possible la rupture de liaisons par exemple.
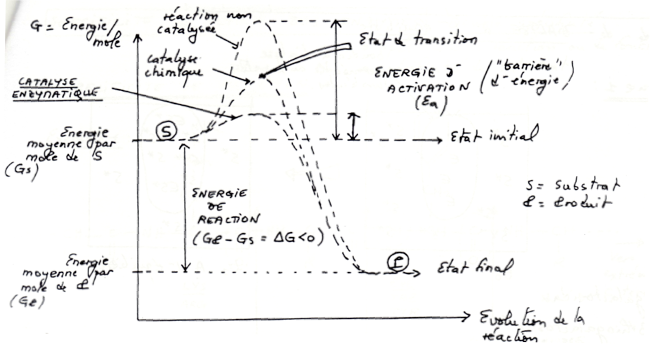
-
•Les enzymes en se liant à un substrat vont le «déformer» et faciliter l’atteinte de l’état de transition et diminuent donc l’énergie d’activation et permet une moindre énergie pour effectuer la réaction. Les enzymes augmentent aussi le nombre de molécules qui atteignent l’état de transition.
-
•Dans une cellule, les réactions sont décomposées en de multiples réactions, l’avantage c’est que la majeure partie de l’énergie n’est pas perdu sous forme de chaleur,ce qui limite la perte d’énergie et l’échauffement des cellules.
-
-
2)Les enzymes ont un pouvoir catalytique élevé
-
-
-
•Il y a toujours une très forte accélération des réactions : d’un facteur situé entre 106 et 1012 (jusqu’à un cas extrême de l’OMP décarboxylique : 1017)
-
•En absence d'enzymes les réactions ne se produiraient pas ou à des vitessse très lentes.
-
•Exemple de l’anhydrase carbonique (dans les hématies)
H₂O + CO₂ ⇔ H₂CO₃ H₂CO₃ + H₂O ⇔ HCO₃ + H₃O+
Seule la première étape est catalysée par l’anhydrase carbonique. -
•Chaques molécules d’enzymes peut hydrater de l’ordre de 106 molécules de CO₂ par seconde. La réaction catalysée est 8.106 fois plus rapide que la réaction non catalysée soit presque 10 million de fois plus rapide que sans enzyme.
-
•Exemple de la TPI = Triose phosphate isomérase
Vitesse de la réaction catalysée : 4,3.103 molécules de DHAP par seconde. Vitesse de la réaction non catalysée est de 4,3.10-4 molécule par seconde.
-
-
3)Les enzymes agissent à faible concentration et ne modifient pas l’équilibre des réaction
-
-
-
•Exemple, si on hydrolyse des protéines de viande dans un tube à essais avec un pH acide à 38°C il faut 3 mois, à la même température avec de la pepsine, il faut 2h.
-
-
4)Les enzymes eéalisent une reconnaissance spécifique et dynamique du substrat.
-
-
A/ Mise en évidence
Mise en évidence d’une complexe [E-S] stéréospécifique.
-
•Méthode de dialyse à l’équilibre.

-
•On utilise une β-galactosidase qui reconnaît en temps normal le β-galactoside. Dans cette expérience, on utilise comme substrat du β-thiogalactoside, il possède un atome de souffre à la place de l’atome d’oxygène. L’enzyme et le «faux» substrat vont se lier, sans que la réaction puisse se faire ce qui entraîne une rétention du «faux» substrat par l’enzyme. Le boudin à dialyse permet la circulation du substrat mais pas de l’enzyme. On a marqué le β-thiogalactoside par un marqueur radioactif. On met enzyme et substrat en présence et au bout de quelque heures, la concentration en substrat marqué est supérieur à l'intérieur du boudin que à l'extérieur. Cela montre que le substrat est lié en partie à l'intérieur du boudin par l’enzyme qui elle ne peut sortir du boudin.

-
•Dans la deuxième expérience, l’ajout d’un second substrat entraîne une baisse de la radioactivité à l'intérieur du boudin. On en conclut que le substrat S° c’est fixé à l’enzyme à la place du premier substrat. Ceci montre que la liaison enzyme substrat est réversible.
-
•Dans une troisième expérience, on refait la même expérience que la deuxième, avec une addition d’un second substrat, un α-galactoside, et là la radioactivité ne change pas. Ceci montre que l’enzyme ne se fixe pas à ces composés, et donc que l’enzyme est spécifique à son substrat.
B/ Une spécificité de réaction de substrat
Exemple de la spécificité de réaction:

Exemple 2 de la spécificité de réaction:

C/ Une une reconnaissance dynamique: l’ajustement induit
-
•Lorsque une enzyme rencontre son substrat, il y a un ajustement de forme de l’enzyme et du substrat pour s’accorder ➞ liaison dynamique ( pas vraiment comme une clef et une serrure)
-
III)Nature chimique, organisation et localisation des enzymes
-
-
1)L’enzyme peut être constituée exclusivement d’une protéine (enzyme holoprotéique)
-
-
-
•On peut avoir dans se groupe d’enzyme holoprotéiques des enzymes monomériques
-
•La ribonucléase pancréatique 124 AA, MM: 13 700g.
-
•Le lysozyme 129 AA, MM 14 600g.
-
•La trypsine 223 AA
-
•L’hexokinase de levure...
-
•Il y a aussi des enzymes oligomériques, composées de plusieurs oligomères.
-
•La triose phosphate isomérase (TPI), enzyme de la glycolise qui dans les cellules se trouve sous forme de 2 protomères identiques et symétriques, découverte en 1875.
-
•PhosphoFructoKinase (PFK), enzyme de la glycolyse aussi, c’est un homotétramère.
-
•AspartateTransCarbamylase (ATCase), formée de 3 sous unités catalytiques et 3 unités régulatrices multipliés par 2 [ C₃R₃ * 2].
-
2)L’enzyme peut etre constituée d’une proteine et d’un cofacteur non protéique (holoenzyme = cofacteur + apoenzyme)
-
A/ Des cofacteurs métallique = ions
-
•25 des enzymes contiennent des ions,par exemple :
-
•Zn2+ dans l’anhydrase carbonique ou la phosphatase alcalines.
-
•Mg2+ dans toutes les enzymes fonctionnant avec l’ATP.
-
•L’héxokinase ne reconnaît que le complexe Mg-ATP
-
•Protéine Fer-Souffre et cytochromes des chaînes redox de la mitochondrie sont des ions important pour le fonctionnement de ses protéines.
B/ Des cofacteurs organique = coenzymes
-
•Un groupement prosthétique est une coenzyme lié de façon covalente à l’enzyme, et la coenzyme reste liée étroitement à l’enzyme, sans s’en détacher. C’est le cas des coenzymes Fladilique ( FAD comme la succinodéshydrogénase, Hème des cytochrome,...)
-
•Groupement co-substrat, c’est à dire que la coenzyme se comporte comme un deuxième substrat. Ce co-substrat n’est pas lié de façon permanente à l’enzyme, mais indispensable pour que la réaction se produise (NAD+/NADPH,H+; ATP).
-
-
3)Cas particuliers
-
-
A/ Complexe multi-enzymatiques
-
•C’est une association d’enzymes dans un même complexe moléculaire tel que le complexe de la pyruvate déshydrogénase. C’est un complexe formé de 3 enzymes distinctes qui catalysent 5 réactions. Il est présent dans la matrice mitochondriale. Il transforme le pyruvate en acétyl Co-A.
B/ Ribozymes
-
•Découvert en 1981 sur un protozoaire Cilié : tétrahymena. On y a découvert un ARN ayant un rôle catalytique.
-
•Les enzymes peuvent donc être aussi des ARN en plus que des protéines.
-
•Activité peptidyl-transférase dû à l’ARN 28S du ribosome.
4) Localisation des enzymes
-
•On les trouve dans le milieu extracellulaire. On peut trouver des enzymes sécrétés dans le milieu extracellulaire (enzymes digestives, lysozyme...) ou des enzymes circulant dans le plasma (protéines de la coagulation).
-
•On trouve les enzymes dans tout les compartiments du milieu intracellulaire, avec des fonctions spécifiques.
-
•On les trouve aussi dans les membranes, comme la succinodéshydrogénase dans les membranes des mitochondries.
